

宿主细胞蛋白(HCP)的法规要求对于确保生物制药产品的质量和安全性至关重要。经测试,残留的HCP可能引起不良反应,如免疫反应,也需要关注到的是残留的HCP可能影响药物的活性,导致药物效果降低,影响治疗效果。这些负面影响会直接导致药物的安全性问题,甚至可能对患者的健康产生威胁。例如,某些研究表明,ECP(大肠杆菌多肽)的存在与抗ECP抗体和抗rhGH抗体的产生相关,可能导致免疫反应等。
HCP残留含量也被认为是生物制品的关键质量属性(CQA),是工艺稳健性监测的重要评价指标,也是产品的重要质控指标。对于HCP的法规要求是多层次、多方面的,旨在确保生物制药产品的安全性、有效性和质量。许多国家和地区的药品监管机构都要求生物药物在上市前必须进行HCP残留的检测。这是为了确保药物的安全性和有效性,满足法规要求。制药企业应严格遵守相关法规要求,采用合适的检测方法和控制策略,确保HCP残留量在可接受范围内。
1.国际法规要求:
ICH Q6B指南:国际人用药品注册技术协调会(ICH)的Q6B指南指出,需要根据ICH准则采用敏感且经过验证的有效方法来监控残留的HCP,其残留量通常要求小于100ppm。
美国药典(USP):USP<1132>章节规定,用一种灵敏度较高的方法检测药品中的HCP,其含量应该低于检测限(通常小于100ppm,即1mg总蛋白中HCP含量应小于100ng,也即<0.01%)。
欧洲药典(EP):EP 2.6.34中规定,在生物制品中,HCP的含量应当小于0.1%。
2.国家/地区药典要求:
中国药典(2020版):
针对CHO细胞,HCP残留需要<0.05%(相当于小于500ppm)。
针对E.coli,HCP残留需要<0.01%。
其他国家:不同国家和地区的药典可能有各自的HCP残留标准,但都旨在确保生物制药产品的安全性和质量。
而在实验室中常规的宿主细胞蛋白残留检测方法如下:
1、酶联免疫吸附试验(ELISA)
原理:利用特异性抗体与宿主蛋白结合,通过测定抗原-抗体反应来定量宿主蛋白的残留水平。
优点:灵敏度高,可用于定量检测。
缺点:需要有针对特定HCPs的抗体,可能产生假阳性或假阴性的结果。
自动化:可以使用自动化工作站,如Biomek i7,来提高准确性和检测通量。
2、二维电泳-质谱联用法(2D-PAGE-MS)
原理:基于蛋白质分子量和等电点差异进行分离,通过质谱分析进行蛋白质鉴定。
优点:可检测更广泛的HCPs,提供全面的蛋白质谱。
缺点:操作复杂,需要较高的技术水平。
3、多肽映射法
原理:通过蛋白质酶切、高效液相色谱、质谱等步骤,获得蛋白质的多肽图谱,进行结构鉴定和定量分析。
优点:准确性高,适用于复杂样品的分析。
缺点:操作步骤复杂,需要较高的技术水平和专业设备。
4、电泳法
包括CIE(毛细管电泳)、SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)等。
优点:反应时间短、灵敏性高(如CIE)。SDS-PAGE简便、快速、重复性好。
缺点:分辨率低(如CIE、SDS-PAGE)、不能精确定量(如SDS-PAGE)。
5、质谱法
原理:直接检测蛋白质的质量和结构,通过比对目标蛋白和宿主蛋白的质谱图谱进行定量分析。
优点:高灵敏度、高分辨率,可同时检测多个宿主蛋白。
缺点:需要复杂的样品准备和数据分析过程。
6、生物活性测定法
原理:通过测定宿主蛋白对生物活性的影响来验证残留。
优点:提供宿主蛋白残留对药物活性的直接影响信息。
缺点:可能在特定情况下不够敏感或特异性。
在选择宿主细胞蛋白残留检测方法时,需要考虑多个因素,包括所需的灵敏度和准确性、样品的复杂性、以及可用的设备和技术水平。通常,结合多种方法可以确保最终药物产品的质量和安全性。
今天小贝带来了
基于ELISA的自动化检测宿主细胞蛋白残留标准化流程——标准化无人值守

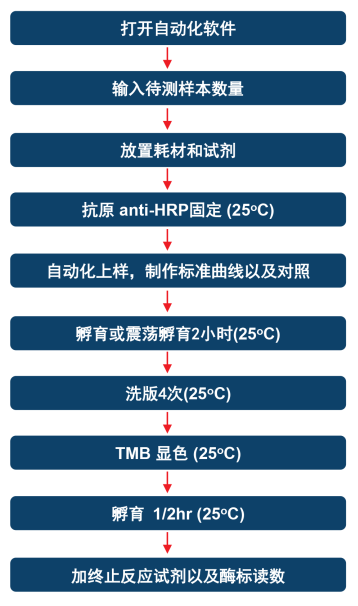
图1. 自动化HCP检测流程展示
更高线性的标曲——高精度移液体现
自动化 人工
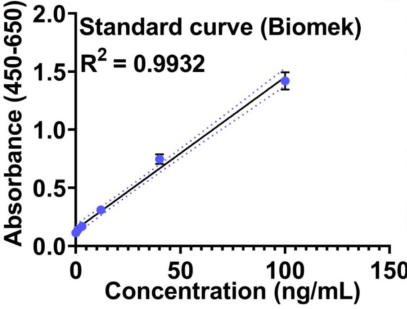
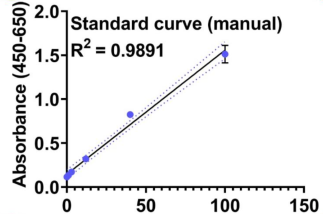
图2. 使用CygnusTM CHO HCP ELISA 试剂盒对于自动化再现性的验证。手工和自动化的标曲比较结果如图二A和B所示,对比R2的数值自动化动化结果更好。
稳定的结果保证——高重现性
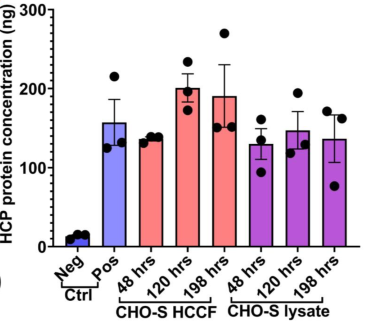
使用Biomek i7自动化工作站完成对不同时间宿主细胞培养基和细胞裂解液的蛋白定量检测。
贝克曼库尔特生命科学提供专业的软件硬件支持,以及客户应用开发来满足大家对于生命科学自动化的需求。
关于贝克曼库尔特生命科学自动化整合部门介绍:
1、贝克曼自动化整合部门位于美国Indianapolis,该部门位于Beckman质量管理系统下,并经过ISO9001认证,部门配备整合实验室,完成整合设备的研发。
2、整合部门人员包含机械、电子、软件、系统工程师,和工程师支持、项目管理人员。
3、人员配备齐全,售前售后响应快速。
4、如有特殊功能开发,Beckman团队可协助客户在国内进行软硬件开发和测试。
*以上内容涉及设备仅适用于科研和工业,不用于临床诊断。
