腺病毒感染细胞的原理是通过纤突蛋白和细胞表面CAR结合。腺病毒黏附之后,五邻体蛋白上的精氨酸-谷氨酸-天冬氨酸与细胞表面的整合素αvβ3和αvβ5结合并相互作用使腺病毒进入细胞。Ad5腺病毒的高效感染依赖于细胞膜上的CAR和αvβ整合素,但是有些免疫细胞的细胞膜上缺乏这些受体,通过研究发现F35血清型对造血干细胞有很强的靶向性,因此,嵌合型Ad5/F35由此产生。
对于Ad5/F35的感染效率,可以参考下面这些文献中Ad5/F35的具体感染效果。
转导 Ad5F35-eGFP 24 小时后骨髓间充质干细胞的转染效果图[1]
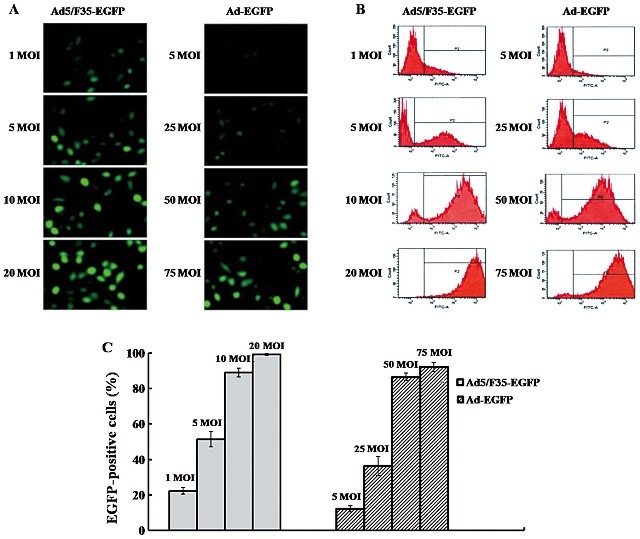
SMMC-7721 细胞感染了 Ad5-EGFP 或 Ad5/F35-EGFP 的效果图[2]
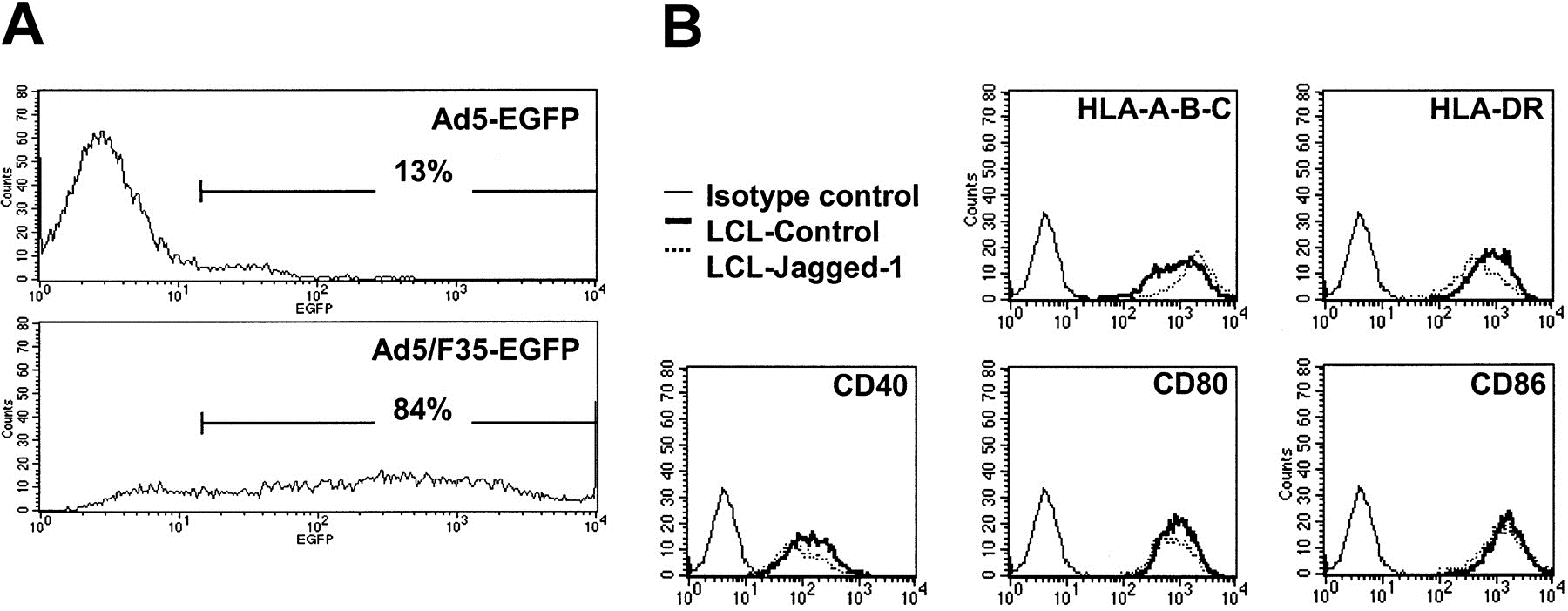
EBV-LCL 细胞中 Ad5 和 Ad5/F35 感染性的比较[3]
基于此,吉凯基因开发了一种嵌合型的腺病毒Ad5/F35,对于造血干细胞的靶向性大大增强。对于改造的原理方面,我们需要先了解一下腺病毒Ad5的结构:腺病毒是一种双链线性的DNA病毒,其基因组长度约36kb。基因组两端各有一个103bp的反向重复序列(ITR),参与病毒DNA的复制;Adv是一种无包膜的DNA病毒,其复制不依赖于宿主细胞的分裂,有50余种血清型,大多数腺病毒载体基于血清型2和血清型5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。下面是人类血清型5型腺病毒基因组的示意图:
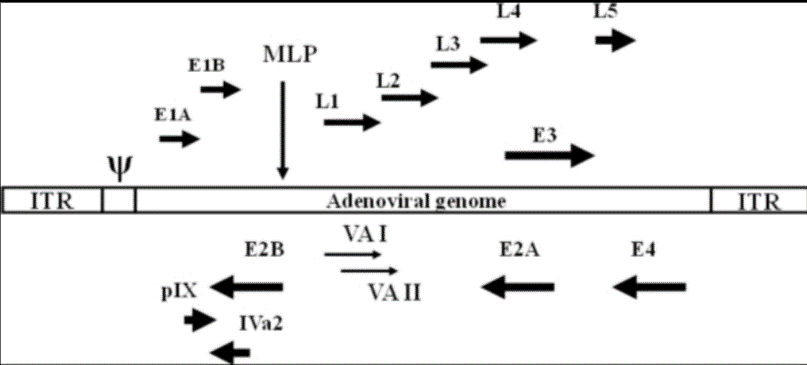
人腺病毒血清型5的转录图谱[4]
嵌合型的腺病毒Ad5/F35,在Ad5的基础上,其受体结合位置的纤突改造成了F35型的纤突,下图是Ad5/F35的结构图。
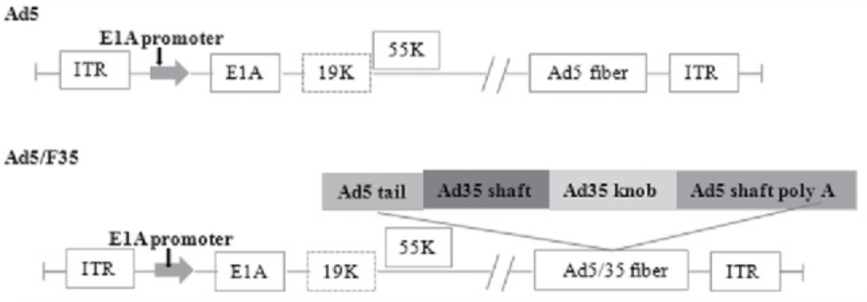
Ad5和 Ad5/F35 的结构图[5]
下图是我们根据不同的文献[6-9],总结的对于不同的细胞Ad5/F35的MOI的推荐值。因为不同的细胞和以及实际操作的不同,建议各位老师根据推荐的MOI做相关预实验确定实际感染的MOI。

下面根据一篇文献Chimeric Ad5.F35 vector evades anti-adenovirus serotype 5 neutralization opposing GUCY2C-targeted antitumor immunity[10],我们可以了解一下嵌合腺病毒载体 (Ad5/F35) 诱导对肿瘤相关抗原鸟苷酸环化酶 C (GUCY2C) 的免疫反应的能力。
Ad5介导基因转移和诱导有效免疫反应的能力使其成为针对癌症和传染病的实验性疫苗的流行载体。由于 Ad5 感染在许多人群中流行,因此全球 >70% 的人口中预先存在的 NAb 限制了基于 Ad5 的疫苗策略。这些考虑凸显了改进载体的必要性,所以研究人员试图通过用罕见的腺病毒血清型 Ad35替换 Ad5 纤毛来克服预先存在的 Ad5 NAbs,以提高表达胃肠道 (GI) 癌症抗原鸟苷酸环化酶 C (GUCY2C) 的小鼠模型中的抗肿瘤免疫力。该试验表明,人源化版本的疫苗(Ad5-GUCY2C-PADRE)在常规治疗后安全地诱导了结直肠癌患者的GUCY2C特异性CD8 T细胞反应。然而,在接种 Ad5-GUCY2C-PADRE 疫苗后,具有高 NAb 对 Ad5 的预先存在的滴度的患者未能产生 GUCY2C 特异性免疫。为了克服 Ad5 NAbs,研究人员生成了一种嵌合 Ad5 载体,该载体具有 Ad35 纤毛 (Ad5/F35),在小鼠和人类中具有与 Ad5 相当的安全性和抗肿瘤活性以及对 Ad5 NAbs 的抗性。这种嵌合疫苗可以转化为胃肠道癌症患者,不仅可以在Ad5免疫力低的患者中,而且在已有的Ad5 NAbs高的患者中安全地诱导GUCY2C特异性免疫。
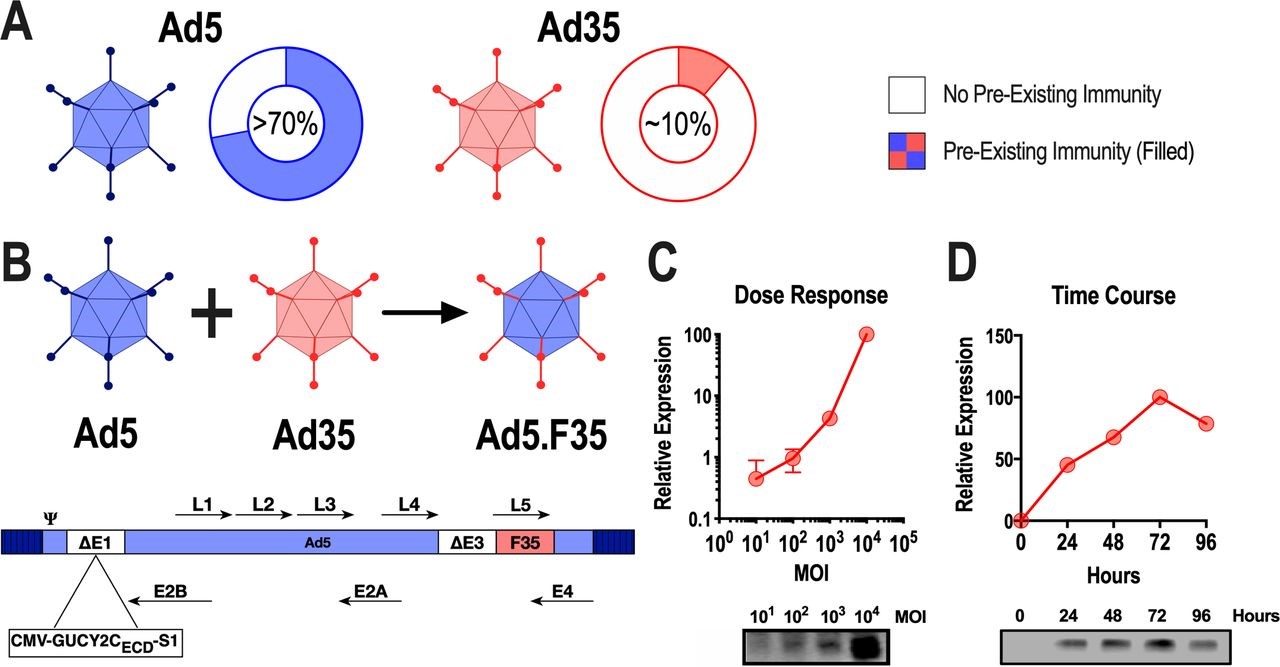
Ad5.F35-GUCY2C-S1的构建和抗原表达
先前的研究表明,Ad5-GUCY2C疫苗在转移性结直肠癌小鼠模型中诱导了保护性抗肿瘤CD8 T细胞反应。因此,用表达GUCY2C-S1的Ad5或Ad5.F35对BALB/c小鼠进行免疫,并在7天后用表达GUCY2C和萤火虫荧光素酶的CT26结直肠癌细胞进行攻击。如前所述,Ad5疫苗接种几乎消除了转移性肿瘤负荷,延缓了疾病进展,并提高了生存率。同样,Ad5.F35也降低了肿瘤负荷、疾病进展和延长生存期。重要的是,基于Ad5和基于Ad5/F35的GUCY2C疫苗在减轻肿瘤负荷、防止疾病进展和促进生存方面的功效相同。
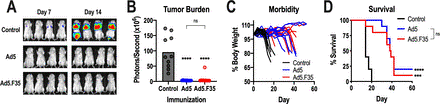
Ad5-GUCY2C-S1 和 Ad5.F35-GUCY2C-S1 的抗肿瘤功效
参考文献…
1.Pablo Bosch, Scott L. Pratt, et al., Isolation, Characterization, Gene Modification, and Nuclear Reprogramming of Porcine Mesenchymal Stem Cells. Biol Reprod,2005. 74(1):46-57.
2.Yanping Cun, et al., Combined use of adenoviral vector Ad5/F35-mediated APE1 siRNA enhances the therapeutic efficacy of adenoviral-mediated p53 gene transfer in hepatoma cells in vitro and in vivo., Oncol Rep. 2013 Jun;29(6):2197-204.
3. Eric S Yvon, Stephane Vigouroux., Overexpression of the Notch ligand, Jagged-1, induces alloantigen-specific human regulatory T cells., Blood. 2003 Nov 15;102(10):3815-21.
4. Vetrini, F. and P. Ng, Gene Therapy with Helper-Dependent Adenoviral Vectors: Current Advances and Future Perspectives. Viruses, 2010. 2(9): p. 1886-1917.
5. Yang, M., et al., A novel fiber chimeric conditionally replicative adenovirus-Ad5/F35 for tumor therapy. Cancer Biology & Therapy, 2017. 18(11): p. 833-840.
6. Kai Wabg, Jian-Qinag Peng, et al., Transfection efficiency of adenoviral vector AD5/F35 to malignant hematopoietic cells of different origins. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2006 Jun;14(3):525-8.
7. Marie-Pierre Cayer, Mathieu Drouin, et al., Comparison of promoter activities for efficient expression into human B cells and haematopoietic progenitors with adenovirus Ad5/F35. J Immunol Methods. 2007 Apr 30;322(1-2):118-27.
8. P Yotnda , H Onishi, H E Heslop, et al., Efficient infection of primitive hematopoietic stem cells by modified adenovirus. Gene Ther. 2001 Jun;8(12):930-7.
9. Akira Itoh, Takashi Okada, et al., A soluble CAR-SCF fusion protein improves adenoviral vector-mediated gene transfer to c-Kit-positive hematopoietic cells. J Gene Med. 2003 Nov;5(11):929-40.
10.Flickinger Jr, J.C., et al., Chimeric Ad5.F35 vector evades anti-adenovirus serotype 5 neutralization opposing GUCY2C-targeted antitumor immunity. Journal for ImmunoTherapy of Cancer, 2020. 8(2).
