作者:DJ孟
circRNA是一类闭合环状的非编码RNA分子,起初被认定为是转录副产物,但后来随着高通量测序和实验技术的不断发展,人们发现了很多具有功能的circRNA。研究表明circRNA在生物的生长发育、疾病的发生和发展过程中发挥着重要作用,其在疾病诊断标记物方面有很大的应用前景。
本文围绕circRNA的形成与鉴定、功能机制和circRNA的上下调方式等展开阐述,希望能为初进circRNA研究领域的新手小白提供帮助!
一、circRNA的形成
根据circRNA的组成结构不同,将其分为内含子ciRNA、外显子ecircRNA和内含子-外显子ElciRNA三类。不同类型circRNA的成环机制也有所不同,主要有4种:
(1)环化外显子5’和3’剪接处通过不断组装小核核糖体蛋白,形成套索结构,引起外显子跳读,驱动环化;
(2)环化外显子的两侧翼内含子通过碱基互补配对,形成并排双链从而驱动环化;
(3)RNA结合蛋白(RBP)通过结合侧翼内含子序列,促进外显子的环化;
(4)内含子依靠5‘和3’端的motif序列反向拼接驱动环化,后经剪切形成成熟的circRNA。
知道circRNA的组成和环化机制后,我们可以挑选表达差异较显著的circRNA进行序列分析,并做下一步的环状结构验证。
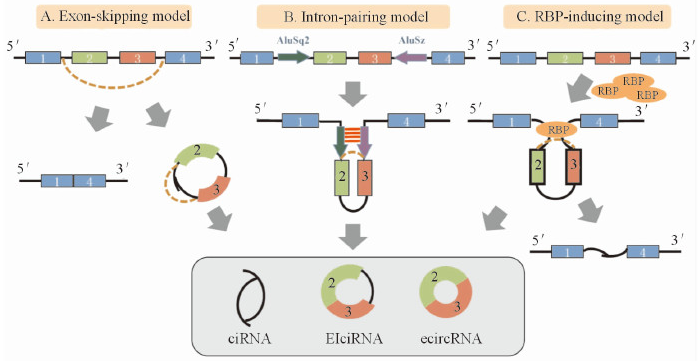
circRNA的形成机制图9
二、circRNA的鉴定
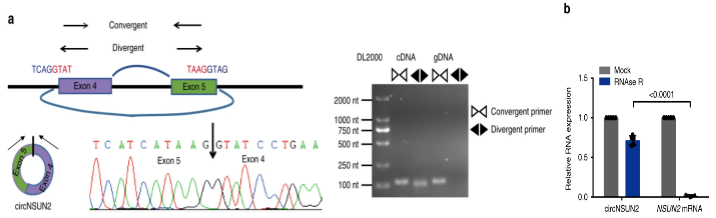
针对circRNA环状结构的鉴定,第一步就是先针对环化序列两侧设计反向引物,sanger测序得到拼接位点序列。因为circRNA是闭合环形,比线性RNA结构稳定,可以利用R NaseR外切酶消化总RNA,检测消化前后circRNA的表达,富集到大量的circRNA。
另外,利用特异性探针进行Northern blot检测和转录抑制剂放线菌素D检测半衰期,进一步证明circRNA的环状结构。
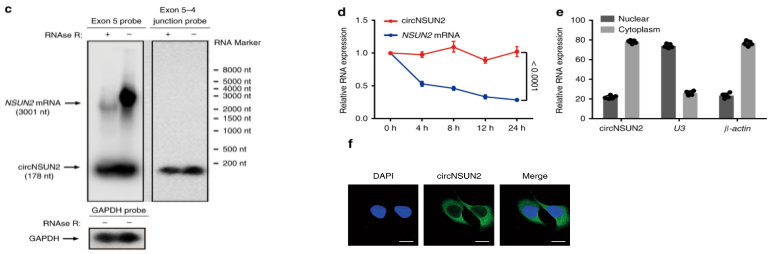
最后,要想研究circRNA的功能机制,首先要知道circRNA在细胞中的定位,不同定位的circRNA对应的功能机制也不同,可以通过核质分离和FISH检测circRNA的细胞定位1。
三、circRNA的作用机制
对于定位在细胞核内的circRNA主要有2种作用机制:
a. circRNA可以与环化位点处的宿主基因结合,通过形成 RNA-DNA 杂合体(R 环结构)使基因转录暂停或终止,导致表达转录本被截短2;
b. EIciRNA通过与 U1 snRNP 、Pol II 相互作用于亲本基因启动子区,从而增强基因的转录过程3。(详细参考:核内circRNA的机制研究如何开展?)
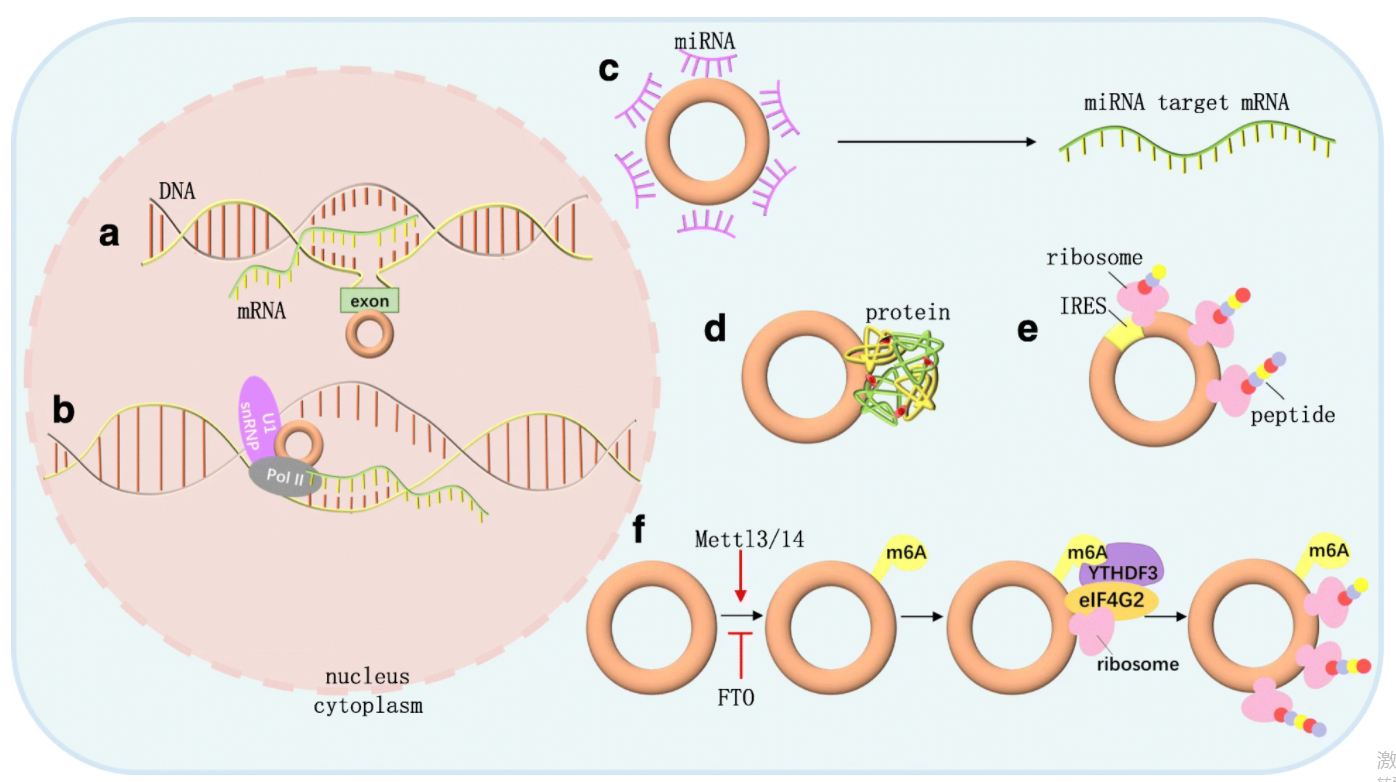
circRNA的作用机制图9
而定位于细胞质内表达的circRNA作用机制大致有4类:
c. ceRNA机制,算是比较经典并且做得最多的研究思路。CircRNA通过充当miRNA的分子海绵,上调miRNA靶标mRNA的表达。比如CDR1as包含63个保守的miR-7结合位点,它通过间接调控miR-7靶标mRNA的表达,影响斑马鱼中脑的发育4和肿瘤疾病等进程5。
d. circRNA通过与蛋白互作,进一步促使蛋白之间结合或分离,可能也会导致结合蛋白在细胞核或细胞质中滞留。另外,circRNA能够促进RBPs与mRNAs的结合,从而通过稳定mRNAs促进翻译过程,如circPOK与白介素增强子结合因子2/3(ILF2/3) 复合物作用,稳定了IL-6和VEGF,间接调控肿瘤的发生过程6。
最后2种功能机制与circRNA的翻译潜能有关。
比如e. 具有ORF和IRES元件的circRNA可以直接招募核糖体启动翻译。
f. 对于那些没有IRES,但是含有M6A位点的circRNA通过识别并结合YTHDF3,招募eIF4G2,从而起始翻译7。(关于circRNA编码的预测和验证,详细可参考:突破认知:LncRNA、circRNA编码啦!!)
四、circRNA的上下调
如果要研究某个感兴趣的circRNA作用机制时,那研究过程中一定少不了对circRNA进行敲低/敲除和过表达。
对于敲低circRNA来说,首先要针对circRNA环化拼接位点处设计特异性敲低靶点,这样可以防止对亲本基因的敲低。另外,由于RNA诱导沉默复合体存在细胞质中,所以,一般siRNA对细胞核内的circRNA敲低效率较低,这时可采用化学合成的ASO敲低基因的表达3。
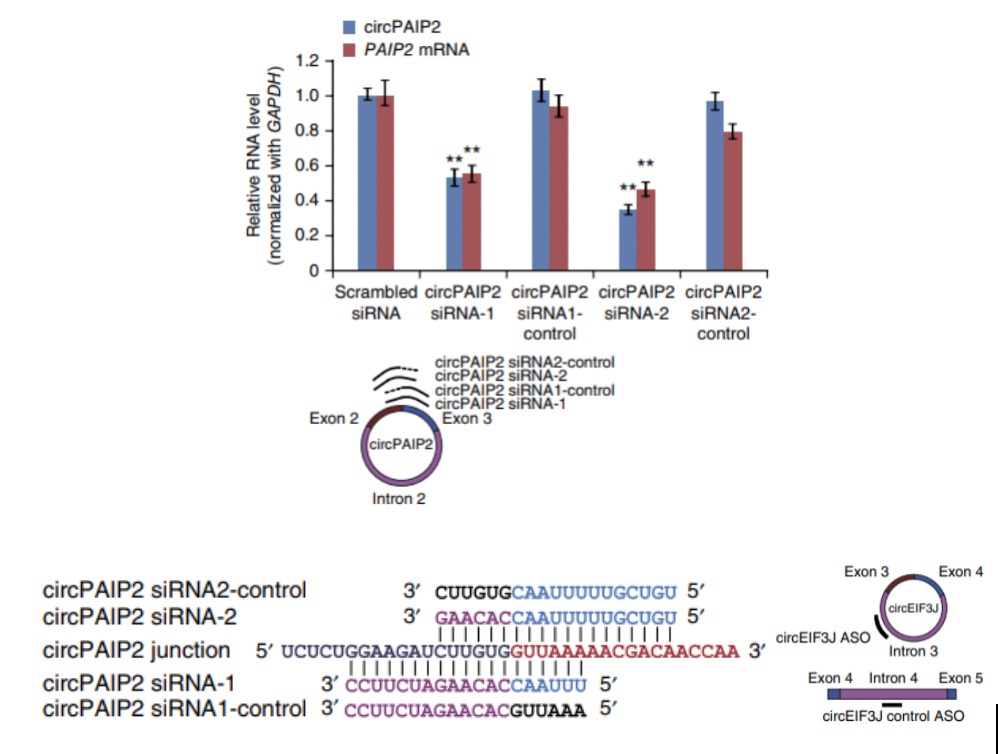
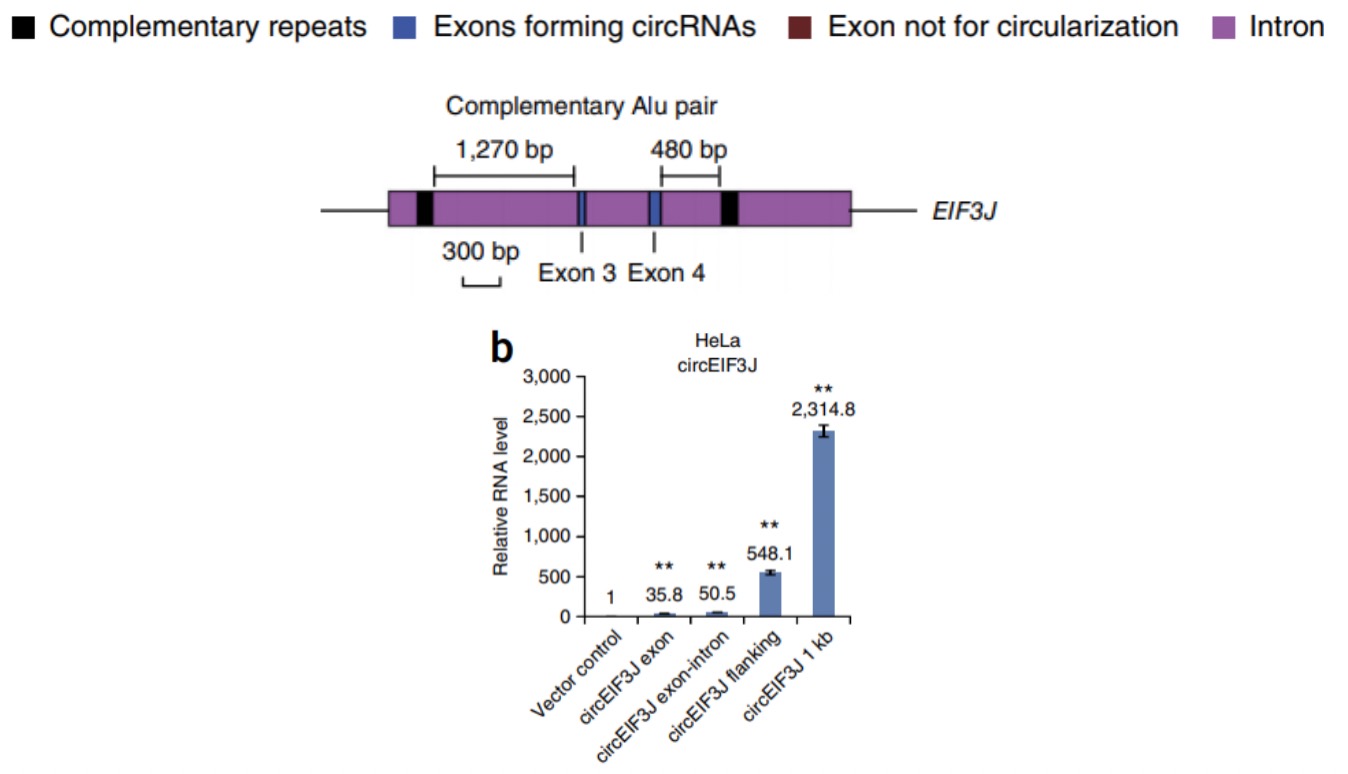
如果要敲除掉circRNA的话,由于circRNA侧翼内含子中的短散在元件SINE(Alu)序列有助于外显子环化,所以可以利用CRISPR/Cas9技术将侧翼内含子的Alu序列敲除,通过阻止反向剪接过程达到circRNA敲除的目的,同时也能避免对亲本基因的表达产生影响8。但是,这可能存在ALU选择困难或者影响其他circRNA形成的问题。对于内含子circRNA,可以将整个内含子敲除掉。但是由于CRISPR/Cas9敲除操作复杂,动物水平敲除效率较低,所以一般建议先做siRNA敲低,如果敲低无效再选择敲除的方式。
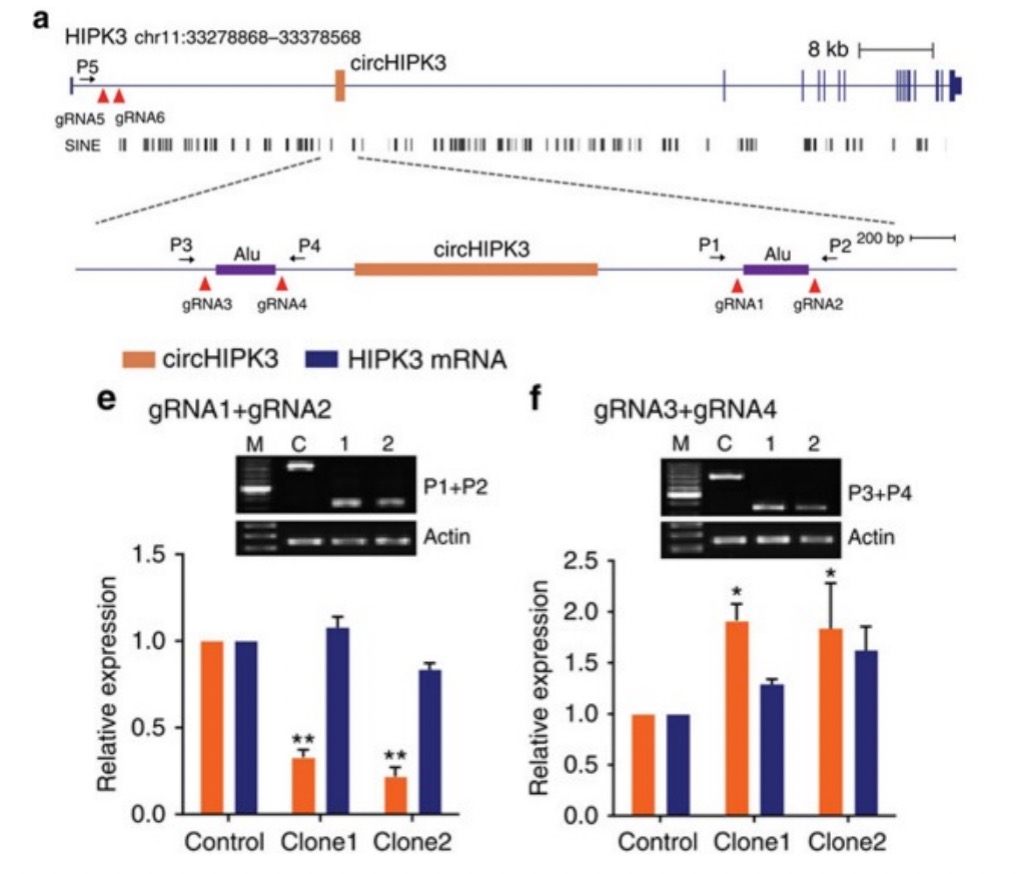
针对circRNA的过表达,主要有2种构建方法:
a. 由于circRNA本身就能环化,所以将circRNA两侧的内含子序列充当环化臂进行构建;
b. 另外,也可以取一侧内含子序列1kb,另一 侧构建互补序列充当环化臂,最后检测circRNA的过表达效率,取最佳构建方式3。
不过,现在不用那么麻烦去检测哪种方式效率最高,直接把circRNA线性序列插入到商业化的circRNA过表达载体(带有环化臂)中,即可驱动环化实现过表达。
实际上,circRNA的功能最终涉及与其他分子的相互作用,虽然我们知道了很多机制,但是仍然存在很多问题没有答案。比如:有没有与circRNA结合的ncRNA或其他分子?是什么决定了circRNA成为蛋白的支架?应该怎样分析位于其他细胞器中的circRNA呢?或者怎样能将circRNA递送到特定的亚细胞区?怎样才能观测到体内实时circRNA-蛋白质相互作用的过程呢?等等这些都需要我们不断地探索。
在探索过程中,吉凯基因可以为广大老师们提供ceRNA机制荧光素酶构建、circRNA编码验证、circRNA过表达载体构建、circRNA敲低/敲除等方案设计。另外,吉凯拥有质粒、慢病毒、腺病毒和AAV多种工具载体,满足老师们的大部分实验需求,助力老师们在circRNA领域的实验研究。

公众号底部菜单栏【新功能】上线!
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来关注一波吧
参考文献…
1.Ri Chen, et al. N6-methyladenosine modification of circNSUN2 facilitates cytoplasmic export and stabilizes HMGA2 to promote colorectal liver metastasis. Nature Communications. 2019, 10(16): 4695
2. X Xu, et al. CircRNA inhibits DNA damage repair by interacting with host gene. Mol Cancer. 2020, 19(1): 128
3. Z Li, et al. Exon-intron circular RNAs regulate transcription in the nucleus. Exon-intron circular RNAs regulate transcription in the nucleus[J]. Nature structural & molecular biology. 2015, 22(3): 256-264
4. Zhong Q, Huang J, Wei J, Wu R. Circular RNA CDR1as sponges miR-7-5p to enhance E2F3 stability and promote the growth of nasopharyngeal carcinoma. Cancer Cell Int. 2019, 19: 252
5. Memczak S, Jens M, Elefsinioti A, Torti F, Krueger J, Rybak A, et al. Circular RNAs are a large class of animal RNAs with regulatory potency. Nature. 2013, 495(7441): 333–8
6. Guarnerio J, Zhang Y, Cheloni G, Panella R, Mae KJ, Simpson M, et al. Intragenic antagonistic roles of protein and circRNA in tumorigenesis. Cell Res. 2019, 29(8): 628–40
7. Y Yang, et al. Extensive translation of circular RNAs driven by N6-methyladenosine. Cell Research, 2017, 27: 626-641
8. Q Zheng, et al. Circular RNA profiling reveals an abundant circHIPK3 that regulates cell growth by sponging multiple miRNAs. Nat Commun. 2016: 11215
9. W Zhou, Z Cai, J Liu, D Wang, H Ju and R Xu. Circular RNA: metabolism, functions and interactions with proteins. Molecular Cancer, 2020, 12: 172
